Молекулярна біофізика вивчає структуру біологічно важливих макромолекул і фізичні процеси, які лежать в основі їх функціонування.
• первинна структура – послідовність ланок у ланцюгу біополімеру, зв'язаних міцними ковалентними зв'язками;
• вторинна структура – локальне впорядкування окремих ділянок полімерного ланцюга;
• третинна структура – просторова укладка всього ланцюга;
• четвертинна структура – просторове розташування кількох компактно організованих полімерних ланцюгів з утворенням надмолекулярного комплексу.
Сусідні ланки можуть обертатись навколо одинарних (простих) зв'язків, що приводить до утворення різних поворотних ізомерів (конформацій). Конформація – це спосіб укладки полімерного ланцюга за рахунок утворення великої кількості слабких зв'язків, в результаті чого утворюється найбільш термодинамічно вигідна й стабільна просторова структура макромолекули. Інакше кажучи, конформація – одна з просторових форм, яку може приймати лінійна макромолекула при тепловому русі.
Природа високої еластичності – внутрішнє обертання зв'язків. Завдяки цьому макромолекулам властива гнучкість і легка згортуваність ланцюжків.
Тоді як хімічні (валентні) взаємодії визначають первинну структуру макромолекул, слабі зв'язки, які мають електростатичну природу (кулонівські сили), визначають вищі порядки структури. Електростатичні взаємодії: Між двома ізольованими зарядами існує кулонівська сила взаємодії.
Атом складається з ядра й електронів, тому взаємодія між сусідніми атомами має складніший характер. Існує рівноважна відстань, на якій сили притягання між різнойменними зарядами точно компенсуються силами відштовхування між однойменними. При зближенні атомів переважають сили відштовхування, а при віддаленні – сили притягання. Завдяки цьому між ними у рідинах і твердих тілах зберігаються в середньому постійні відстані, атоми й молекули в основному коливаються біля своїх положень рівноваги.
Якщо бокові групи макромолекули наближаються одна до одної, то один атом може перетягнути на себе іон водню від іншого атома. Внаслідок цього ці атоми (групи атомів) заряджаються протилежними зарядами. Це особливо характерно для кислотних залишків –COOH, які легко віддають протон, та для аміногруп, які його приєднують. В області нейтральних pH негативно заряджені аспарагінова і глутамінова кислоти, позитивно заряджені бокові ланцюги лізину, аргініну.
Сили Ван-дер-Ваальса відіграють велику роль в утворенні конденсованих рідин. Біологічні макромолекули також можна розглядати як конденсовану систему. В залежності від того, володіють взаємодіючі молекули власними дипольними моментами чи вони виникають внаслідок поляризації електронних оболонок, існують різні типи сил Ван-дер-Ваальса.
Орієнтаційні (диполь-дипольні) взаємодії: два диполі намагаються повернутись один до одного протилежними знаками. Цьому перешкоджає тепловий рух. Тому енергія взаємодії залежить від температури. Диполями в біомакромолекулах є полярні групи такі як гідроксильна та інші. Диполь-дипольні взаємодії виникають, наприклад, між залишками серину:
–CH2–OH • • • • • HO–CH2–
Індукційні взаємодії у тому випадку, якщо атомна група має власний дипольний момент, тоді вона може навести у сусідній неполярній атомній групі дипольний момент, величина якого залежить від діелектричної сприйнятливості неполярної групи.
Дисперсійні взаємодії виникають між неполярними групами, наприклад між неполярними залишками аланіну:
–CH3 • • • • • CH3–
Утворюються між полярними групами O–H, N–H, S–H і атомами O, N, S, F, Cl, які належать іншій або тій самій молекулі. Усі три атоми знаходяться на одній прямій. Природа водневих зв'язків: електростатичне притягання + ван-дер-ваальсові взаємодії + енергія делокалізації електронів. Водневі зв'язки виникають, наприклад, між пептидними групами.
Завдяки водневим зв’язкам утворюється димер мурашиної кислоти:
Молекула води містить 2 атоми водню, тому може утворити 2 водневі зв'язки із сусідніми молекулами води. Таким чином, кожний атом кисню намагається оточити себе 4-ма атомами водню, які при цьому утворюють тетраедр з атомом кисню в центрі. У рідкому стані утворенню тетраедрів заважає тепловий рух, тільки при замерзанні води атоми утворюють тетраедри, тому густина води більша, ніж льоду. Довжина зв'язку O–H – 0.096 нм, кут між ними – 104.52º.
У сірководні H2S водневі зв'язки набагато слабші, що проявляється в набагато менших температурах замерзання (–83ºС) і кипіння (–62ºС).
Біополімери – білки і нуклеїнові кислоти – функціонують головним чином у воді. Між молекулами води і неполярними атомними групами виникають сили відштовхування – гідрофобні сили.
При розчиненні неполярних молекул у воді рухливість молекул води зменшується, вони впорядковуються у кластерні структури, а отже, ентропія системи зменшується, а вільна енергія зростає:
Це енергетично невигідно, тому неполярні залишки виштовхуються з води. Отже, гідрофобні сили мають ентропійну природу. Гідрофобні амінокислотні залишки: триптофаніл, ізолейцил, тирозил, фенілаланіл, проліл, лейцил, валіл, лізил, гістидил, метионіл; гідрофільні: аланіл, аргініл, цистеїніл, глутаміл, аспартил, треоніл, серил, гліцил, аспарагініл, глутамініл. 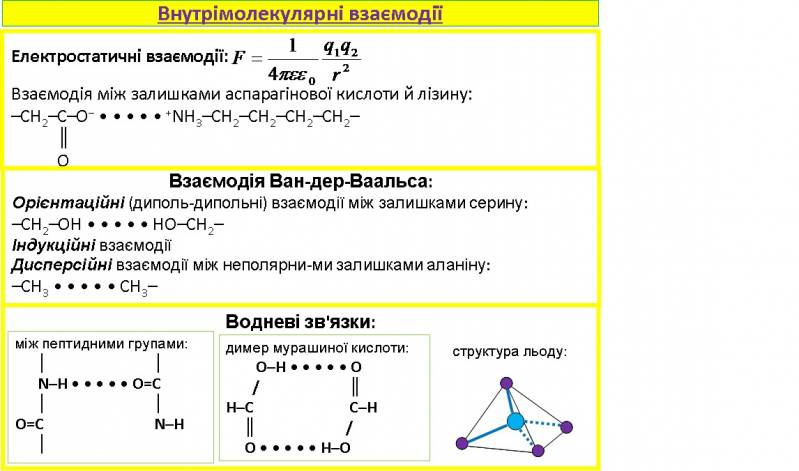 Перейти вище
Перейти вище