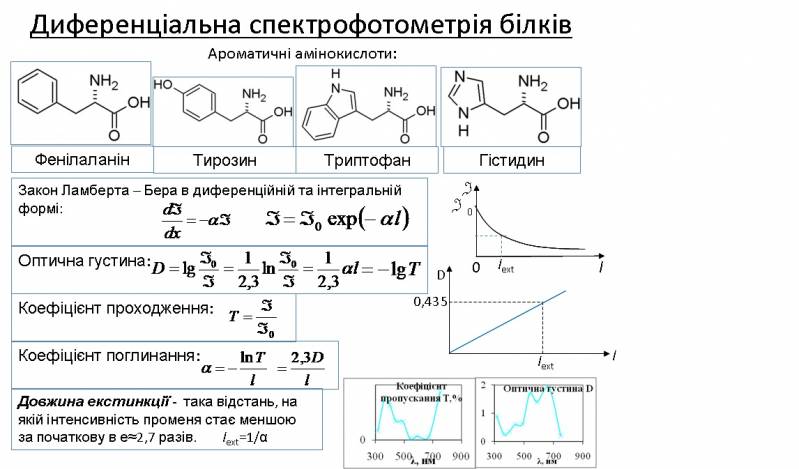
Спектр поглинання білка в УФ області визначається поглинанням ароматичних амінокислот – триптофану, тирозину, фенілаланіну. Основний закон абсорбційної спектрофотометрії – закон Ламберта – Бера.
При проходженні світлового променя через речовину або розчин його інтенсивність поступово зменшується за експоненціальним законом, тобто при проходженні однакових відстаней – в однакову кількість разів. Логарифмічна величина, яка показує, у скільки разів зменшується інтенсивність променя на відстані в одиницю довжини, називається коефіцієнтом поглинання (α), а якщо точніше – це натуральний логарифм відношення інтенсивности падаючого променя до інтенсивности променя, який пройшов одиницю довжини речовини або розчину: 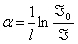 , або ж величина, обернена до відстані, на якій інтенсивність променя стає меншою за початкову в е≈2,7 разів. Він вимірюється в обернених метрах або міліметрах і не залежить від довжини l кювети з розчином.
, або ж величина, обернена до відстані, на якій інтенсивність променя стає меншою за початкову в е≈2,7 разів. Він вимірюється в обернених метрах або міліметрах і не залежить від довжини l кювети з розчином.
Ступінь поглинання всього розчину визначає оптична густина розчину ─ це інтегральний коефіцієнт поглинання всього розчину, величина безрозмірна:
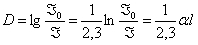
Відношення інтенсивности променя на виході до інтенсивности падаючого променя називається коефіцієнтом проходження (коефіцієнтом пропускання) 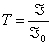 і вимірюється у відсотках. Він пов’язаний з оптичною густиною простим співвідношенням: D=-lgT.
і вимірюється у відсотках. Він пов’язаний з оптичною густиною простим співвідношенням: D=-lgT.
Залежність D(λ) – спектр поглинання, реєструється спектрофотометром.
При конформаційних перебудовах білкових молекул зміщення спектра мале (<0.1 нм) і його важко реєструвати, тому використовується диференціальна спектрофотометрія. Диференціальний спектр – різниця між спектрами поглинання досліджуваної речовини і відомої.
Методи абсорбційної й диференціальної спектрофотометрії використовуються для визначення констант рівноваги дисоціації низькомолекулярних лігандів, констант швидкості асоціації субодиниць у білках, конформаційних змін у білках тощо.
Перейти вище