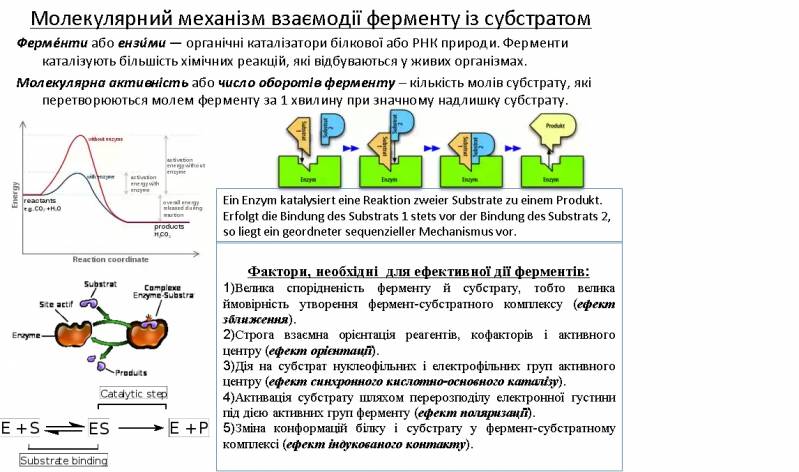
В живому організмі проходить багато оборотних реакцій: гідроліз, розщеплення хімічних зв'язків, ізомеризація, перенос електронів. Велика швидкість реакції досягається завдяки каталізаторам – ферментам. Вони дуже ефективні: підвищують швидкість реакції на 8-20 порядків. Практично всі каталітичні реакції йдуть і без ферментів, але зі значно меншою швидкістю. Ферменти високоспецифічні: діють тільки на один тип субстрату або групу субстратів.
Субстрат безпосередньо взаємодіє з певною малою ділянкою молекули ферменту – активним центром. Більшість ферментів функціонує в комплексі з кофакторами, коферментами (наприклад, із вітамінами). Наприклад, креатинкіназа каталізує реакцію:
Кофактор для цієї реакції – іони магнію. Важливу роль в активному центрі креатинкінази відіграє SH-група. Фермент інактивується йодацетатамідом і йодацетатом. У присутності іонів магнію SH-група захищена від дії цих блокаторів.
Ферменти стереоспецифічні: дзеркальний антипод даного субстрату не є субстратом для даного ферменту.
Ліганд (субстрат або інгібітор) зазвичай взаємодіє з ферментом т.ч.: він впроваджується у порожнину ферменту і контактує з кількома його функціональними групами. При цьому спочатку утворюється ферментсубстратний комплекс, а після перетворення субстрату у продукт реакції останній відділяється від ферменту, і т.ч. фермент готовий до приєднання наступної молекули ліганду.
2) Крупномасштабні конформаційні перебудови зв'язані з відносним рухом структурних доменів. Зміщення – більше 1.5 нм. Наприклад, при зв'язуванні лігандів гексокіназою два домени переміщаються один відносно другого, пептидний ланцюг виконує при цьому роль шарніру. Алькогольдегідрогеназа печінки також складається з 2-х субодиниць, у кожну з яких входять 2 домени, з'єднані поліпептидним ланцюгом. Алькогольдегідрогеназа може знаходитись у 2-х конформаціях – відкритій і закритій (тоді один із них зв'язаний з коферментом НАДН, відповідаючий за перенос електронів в електротранспортних процесах). Після завершення хімічної реакції домени знову розсуваються і продукти реакції виходять назовні. Кут повороту доменів – 30º. Невеликі високочастотні флуктуації білкової структури допомагають знизити високий потенціальний бар'єр (4200 кДж/моль).
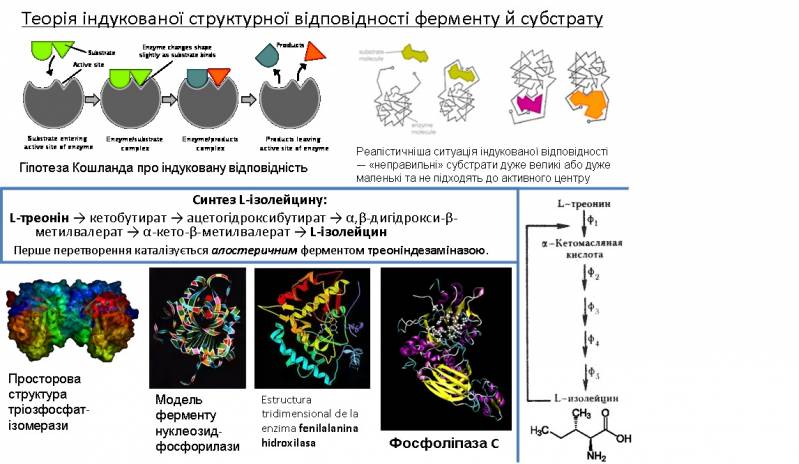
Алостеричні ферменти – ферменти, які мають спеціальні центри зв'язування ефекторів, просторово відділені від каталітичних центрів. Центри зв'язування ефекторів називаються алостеричними. Алостеричні ферменти регулюють, контролюють і каталізують ключові метаболічні реакції в організмі.
Перше перетворення каталізується треоніндезаміназою. Продукт реакції (L-ізолейцин) інгібує треоніндезаміназу, тобто зменшує її каталітичну активність, що приводить до зменшення концентрації L-ізолейцину, що приводить до збільшення швидкості реакції і т.д., тобто активність ферменту регулюється за принципом негативного зворотного зв'язку. Треоніндезаміназа крім активного центру, де каталізується перетворення L-треоніну, має спеціальні центри зв'язу-вання ефекторів (активаторів та інгібіторів), просторово віддалені від каталітичного центру.
Алостеричні ферменти мають субодиничну будову. Гемоглобін складається з 4-х субодиниць, фосфоліпаза – з 2-х, треоніндезаміназа – із 4-х. Аспартаттранскарбомоілаза (АТКаза) (М=300 000) складається з 2-х каталітичних тримерів і 3-х регуляторних димерів, тобто АТКаза містить 6 каталітичних і 6 алостеричних центрів.
Перейти вище