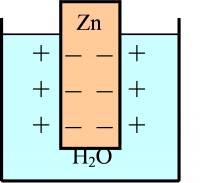
У кристалі металу атоми віддають свої зовнішні електрони в колективне користування:
Перехід іонів металу в розчин відбувається доти, поки не вирівняються електрохімічні потенціали металу між металевою пластиною й розчином. В результаті поверхня пластинки заряджається негативно, тому катіони металу в розчині збираються біля її поверхні. Т.ч. на границі метал – розчин утворюється подвійний електричний шар. Стрибок потенціалу на границі метал – розчин при встановленні рівноваги називається рівноважним електродним потенціалом металу. Процес віддачі атомом електронів і переходу його в розчин – окиснення, протилежний процес приєднання електронів і осадження атома металу на електроді – відновлення. Різні метали мають свій рівноважний електродний потенціал.
При зануренні металевої пластинки у розчин власної солі частина іонів металу також переходить у розчин завдяки різниці хімічних потенціалів. Тільки в насиченому розчині хімічний потенціал речовини рівний хімічному потенціалу твердої фази й переходу не відбудеться. В пересиченому розчині, навпаки, відбувається осадження іонів металу. Отже, остаточний заряд пластини залежить від початкової концентрації катіонів у розчині. При достатньо великій початковій концентрації катіонів у розчині пластина заряджається навіть позитивно, оскільки в цьому випадку на пластині осаджується більше катіонів, ніж переходить у розчин. Отже, величина й знак рівноважного електродного потенціалу залежить від природи металу, концентрації його катіонів у розчині, а також від температури і природи розчинника:
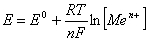
E0 – нормальний (стандартний) електродний потенціал – електродний потенціал, який виникає при зануренні металу в розчин, в якому концентрація іонів цього металу [Men+]=1 моль/л; його знак залежить від концентрації насиченого розчину (при [Men+]насич>1 моль/л E0<0 і навпаки).
При T=298 K (тут [E]=В):
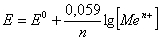
Окиснювально-відновними або редокс-електродами прийнято називати електроди, метал яких не бере участі в реакції, а процес окиснення-відновлення відбувається між окисненою і відновленою формами однієї й тієї ж речовини, яка знаходиться в розчині. Наприклад, платиновий електрод, занурений у розчин з іонами Fe3+ і Fe2+ (рис.6.2), в залежності від концентрації цих іонів може бути донором або акцептором електронів в окисно-відновній реакції:
Якщо рівновага реакції зсунута вліво (при достатньо великій концентрації іонів Fe3+), то атоми платини віддають електрони, за рахунок яких іони Fe3+ відновлюються до іонів Fe2+, електрод отримує позитивний заряд і притягує аніони з розчину. Таким чином на поверхні електрода утворюється подвійний електричний шар із певним стрибком потенціалу, величина якого визначається з рівняння Нернста – Петерса:
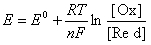
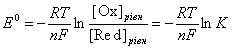 – стандартний редокс-потенціал,
– стандартний редокс-потенціал, [Ox], [Red] – концентрації окисненої і відновленої форм,
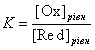 – константа рівноваги окисно-відновної реакції.
– константа рівноваги окисно-відновної реакції.
При T=298 K формула для потенціалу спрощується:
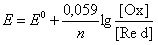
Здатність донора у спряженій окисно-відновній парі віддавати електрон спряженому акцептору характеризується окисно-відновним потенціалом або редокс-потенціалом E0 (у вольтах). Чим більший окисно-відновний потенціал спряженої пари, тим сильніше виражені її окисні властивості. Навпаки, чим менший окисно-відновний потенціал спряженої пари, тим сильніше виражені її відновні властивості.
Редокс-потенціал E0 при однакових початкових активностях (тобто концентраціях) окисненої і відновленої форм – стандартний редокс-потенціал. Отже, редокс-потенціал залежить від стандартного редокс-потенціалу та співвідношення активностей (концентрацій) окисненої і відновленої форм речовини в даному розчині.
Абсолютну величину редокс-потенціалу експериментально виміряти не навчились, тому його визначають відносно стандартного водневого електрода. Стандартний водневий електрод – платинова пластинка, покрита шаром пористої платини і занурена в 1М розчин сірчаної кислоти, через який пропускають чистий водень під тиском 1 атм. Під дією платини молекули водню частково розпадаються на атоми й адсорбуються пористою поверхнею платини. На границі між пластинкою й розчином відбувається окисно-відновна реакція та встановлюється рівновага:
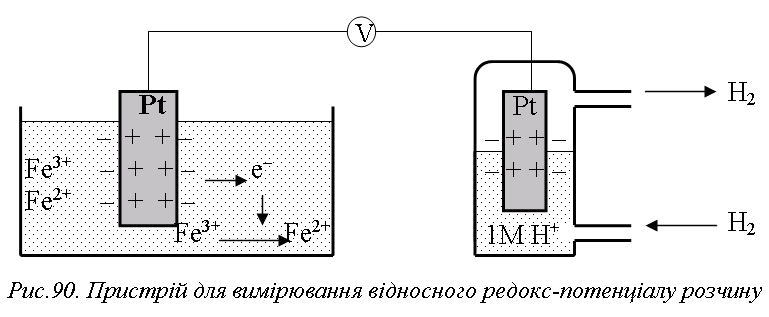
В одну посудину поміщають стандартний водневий електрод, а в другу – інертний металевий електрод (Au або Pt), занурений у розчин з окисненою та відновленою формами відповідного іона. Якщо суміш іонів є кращим окисником, ніж стандартний водневий електрод, то частина іонів окисненої форми відновиться, прийнявши необхідні для цього електрони від платинового електрода, який при цьому зарядиться позитивно відносно стандартного водневого електрода. Якщо суміш іонів є кращим відновником, ніж стандартний водневий електрод, то частина іонів відновленої форми окисниться, віддавши лишні електрони платиновому електроду, який при цьому зарядиться негативно відносно стандартного водневого електрода. Потенціал цього електрода відносно стандартного водневого електрода – це і є редокс-потенціал розчину. У випадку однакових (одномолярних) початкових концентрацій окисненої і відновленої форм ми таким чином одержимо стандартний редокс-потенціал розчину. Для системи Fe3+/Fe2+ E0=+0,77 В (для перетворення Fe2+ → Fe3+ константа рівноваги K=1,1•10-13), а для системи Cr3+/Cr2+ E0= –0,41 В (для перетворення Cr2+ → Cr3+ константа рівноваги K=7,8•106). Якщо достатньо зменшити початкову концентрацію іонів Fe3+, то можна одержати навіть від'ємний редокс-потенціал розчину Fe3+/Fe2+. Платина в цих випадках не бере участі в реакції, а є тільки переносником електронів.
Якщо в одному розчині містяться два сорти іонів, причому кожний з них представлений своєю окисненою і відновленою формами (одна з цих форм може бути у вигляді твердофазного електрода), то окисно-відновна пара з меншим редокс-потенціалом, переходячи в окиснену форму, віддає електрони окисно-відновній парі з більшим редокс-потенціалом, яка при цьому переходить у відновлену форму. Наприклад, якщо розчин містить іони Fe3+, Fe2+, Cu2+, Cu+, (редокс-потенціал системи Cu2+/Cu+ E0=+0,17 В), причому початкова концентрація кожного з чотирьох типів іонів – 1 моль/л, то відбуваються такі окисно-відновні реакції:
Іони заліза відновлюються за рахунок електронів, виділених при окисненні іонів міді. Реакція відбувається доти, поки не зрівняються редокс-потенціали кожної з редокс-пар. При інших початкових співвідношеннях концентрацій іонів можуть відбуватись протилежні окисно-відновні реакції. Наприклад, при [Fe3+]<10-11 М, [Fe2+]=[Cu2+]=[Cu+]=1 М навіть відбувається відновлення міді, але в дуже мізерній кількості.
Більшість біохімічних окисно-відновних реакцій відбувається за участю іонів водню. Наприклад, окиснення молочної кислоти до піровиноградної (пірувату):
2H2O + CH3–CH(OH)–COOH ⇄ CH3–C(O)–COOH +2H+ + 2e-
Редокс-потенціал у цьому випадку визначається з врахуванням концентрації іонів водню, оскільки вони також беруть безпосередню участь в окисно-відновній реакції:
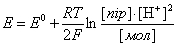
Стандартизація редокс-потенціалів у біохімії та біофізиці відрізняється від електрохімічної. Її проводять при pH=7 (нейтральний розчин). Для обчислення біохімічного редокс-потенціалу необхідно від електрохімічного відняти величину 0,059•pH=0,059•7=0,41 В. Таким чином, біохімічний стандартний редокс-потенціал стандартного водневого електрода E0= –0,41 В. Редокс-потенціал пари ½O2/H2O E0=+0,82 В.