УФ – важливий чинник фотохімічних реакцій. Енергія квантів УФ достатня для дисоціації та іонізації молекул. УФ сильно поглинається тканинами, тому не проникає всередину організму, а впливає тільки на покривні тканини тварин. Біологічне значення має УФ 230-400 нм. Цей діапазон поділяють на 3 області:
• короткохвильова 230-290 нм – поглинається в атмосфері;
• середньохвильова 290-320 нм;
• довгохвильова 320-400 нм.
Біологічна ефективність УФ зростає із зменшенням довжини хвилі. УФ пошкоджує біологічно важливі молекули (білки, нуклеїнові кислоти). Спектр дії пошкоджень часто співпадає із спектром поглинання відповідних речовин. На довжинах хвиль 200-400 нм сильно поглинають з'єднання зі спряженими подвійними зв'язками, із кільцевими структурами. Пуринові і піримідинові основи нуклеїнових кислот поглинають УФ в області 260 нм, ароматичні амінокислоти білків – в області 280 нм.
УФ викликає мутації й загибель мікроорганізмів, клітин людини, тварин, рослин. Спектри дії цих процесів співпадають із спектрами поглинання ДНК і РНК.
У рослин під дією УФ порушується ультраструктура й функції фотосинтетичного апарату, знижується вміст ліпідів у мембранах, розвивається хлороз, гальмується ріст. У найпростіших порушуються рухові реакції. Тварини захищені від УФ шерстю, але може пошкодитись рогівка ока (фотоофтальмія).
У людини малі дози УФ сприяють накопиченню вітаміну D. Розвивається еритема (почервоніння шкіри), що приводить до виникнення загару (накопичення у поверхневих шарах шкіри меланінів) (захисна реакція організму). У розвитку еритеми важливу роль відіграє фотоокислення ліпідів. Нанесення на шкіру антиоксидантів (вітамін Е, іонол) зменшує почервоніння, а ненасичених ліпідів – підвищує чутливість шкіри до УФ. Тривале опромінення може привести до фотоканцерогенезу.
УФ використовується для знезаражування приміщень, хірургічних інструментів, посуду, повітря тощо. Для цього використовуються бактерицидні лампи.
УФ відіграв дуже важливу роль у зародженні життя на Землі та в еволюції.
Основні хромофорні групи ДНК – азотисті основи нуклеотидів (максимум поглинання – 260 нм). УФ приводить до утворення збуджених синглетних і триплетних станів, внаслідок чого піримідинові основи вступають у фотохімічні реакції, найважливіші з яких – реакції приєднання – димеризація, гідратація, утворення зшивок із білками.
Реакція фотодимеризації
З'єднання двох прилягаючих одна до одної піримідинових основ по подвійному вуглецевому зв'язку з утворенням кільця циклобутанового типу. На прикладі тиміну:
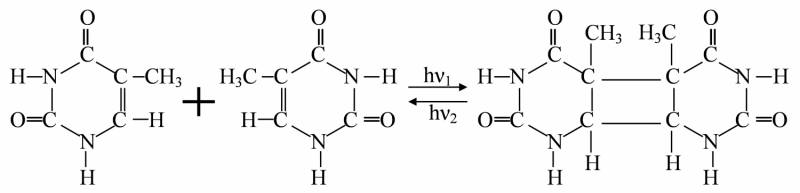 Піримидинові димери дуже стабільні, і в клітинах, де вони виникають, не може відбуватись реплікація ДНК.
Піримидинові димери дуже стабільні, і в клітинах, де вони виникають, не може відбуватись реплікація ДНК.
Для реакції димеризації характерна фотозворотність: при зміні довжини хвилі УФ рівновага реакції зміщується в той чи інший бік. Квантовий вихід реакції фотодимеризації суттєво залежить від ступеня взаємоорієнтації мономерів. Квантовий вихід димеризації тиміну у водному розчині при кімнатній температурі =0,0005, у замороженому розчині =1, в ДНК =0,02.
Дві молекули тиміну у подвійній спіралі ДНК ніколи не розташовуються точно одна проти одної. Тому для того, щоб вони димеризувались, необхідне локальне розплітання ДНК. Отже, УФ виконує 3 функції:
1) Розплітання комплементарних тяжів ДНК біля молекул тиміну (локальна денатурація). Цей процес можна підсилити нагріванням.
2) Димеризація двох молекул тиміну.
3) Утворення зшивки між тяжами, яка закріплює локальну денатурацію.
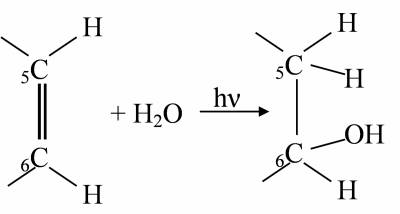
Реакція фотогідратації
Приєднання води до піримидинового кільця з розривом подвійного зв'язку:
Реакція фотогідратації не є фотозворотньою. Але гідрати можуть руйнуватись при t>30ºC і при зростанні іонної сили розчину. Реакція проходить тільки в одноланцюговій ДНК. Тому гідрати піримідинів можуть приводити до летального або мутагенного ефекту тільки у клітин з активними процесами реплікації й транскрипції, в ході яких з'являються короткі одноланцюгові ділянки ДНК.Зшивка з білками
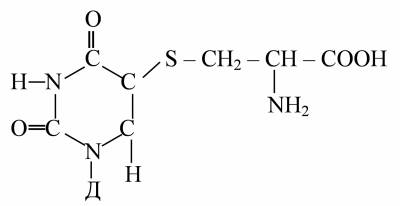
Амінокислотні залишки білка через SH- або OH-групи прикріплюються до C5 або C6 цитозину чи тиміну з розривом подвійного зв'язку:
Під дією УФ на розчини білків – помутніння, зміна в'язкості, зміна швидкості осідання в ультрацентрифузі, зміна оптичного повертання, тобто ознаки денатурації. Активність біологічно активних білків падає. Поглинання світла білками в області 200-400 нм зумовлене ароматичними амінокислотами – триптофаном, тирозином, фенілаланіном, цистином. Квантовий вихід фотоінактивації ферментів невеликий – 0,001-0,01.
При попаданні кванта УФ в ароматичну амінокислоту вона руйнується. Для інактивації ферменту необхідне руйнування певних амінокислотних залишків, які входять в активний центр. Наприклад, для інактивації трипсину достатньо руйнування одного з 4-х залишків триптофану й одного з 3-х залишків цистину. Найбільше значення у фотоінактивації білків має фотоліз триптофану і цистину.
Під дією червоного світла або при нагріванні радикал може рекомбінувати з електроном, при цьому випромінюється квант люмінесценції:
Якщо амінокислоти перебувають у розчині, то далі відбуваються такі процеси:
3а) У розчинах амінокислот без доступу кисню продукти реакції рекомбінують. У присутності кисню радикал взаємодіє з киснем з утворенням перекисного радикала:
4а) Утворення стійких продуктів окислення тирозину й триптофану – диоксифенілаланіну та формілкінуреніну.
Якщо ж амінокислоти перебувають у складі білка, то далі відбуваються такі процеси:
3б) У білку радикал амінокислоти, взаємодіючи з іншими групами, переходить у стійкий продукт. Разом із тим вільний електрон (сильний відновник) та атомарний водень взаємодіють з органічними молекулами, наприклад з аланіном, із виділенням аміаку: