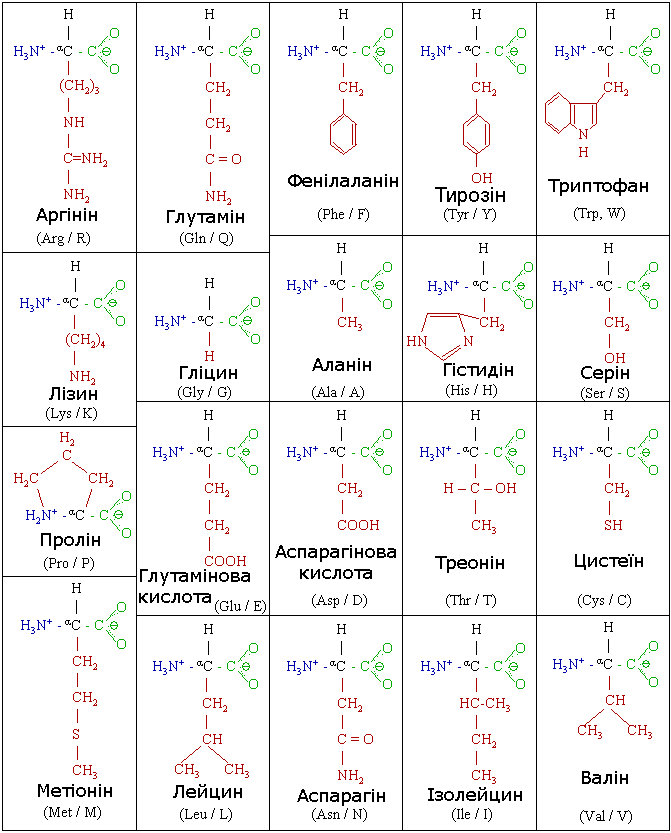
Усього відомо 20 протеїногенних амінокислот і відповідних їм кислотних залишків.
Пептидна група – плоска й жорстка. Вони між собою з'єднані через атом Cα. Довжина зв'язків C–N – 1.32 Å, Cα–N – 1.47 Å, Cα–C – 1.53 Å. Обертання навколо цих зв'язків не є повністю вільне.
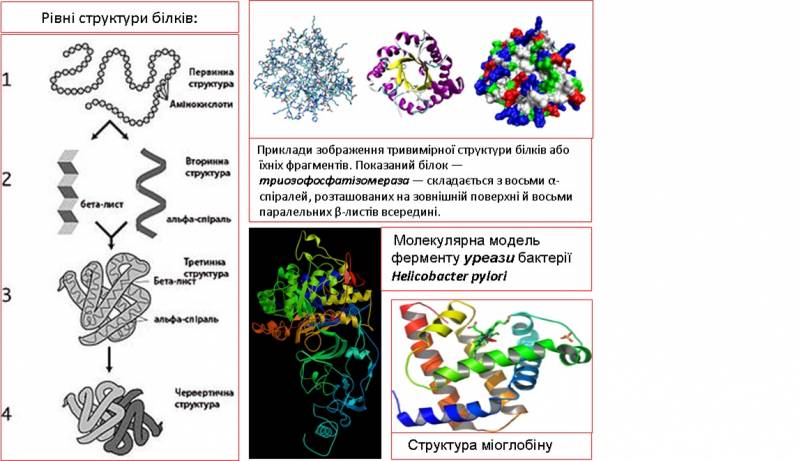
Білки мають властивість скручуватись у спіраль. Тоді між пептидними групами виникають водневі зв'язки (взаємодіють пептидні групи, між якими є дві, тобто перша з четвертою і т.д.). Таким чином утворюється вторинна структура білка – упорядковане розміщення поліпептидного ланцюга, стабілізоване водневими зв'язками.
Права α-спіраль найбільш енергетично вигідна і найчастіше зустрічається. Кількість амінокислотних залишків на 1 крок спіралі – 3.6, крок спіралі – 5.4 Å, радіус спіралі – 2.3 Å.
Інший тип вторинної структури – паралельні й антипаралельні β-складчасті листи (β-структура). Пептидні групи з'єднуються у виді складок (не більше 6 у ряд), наступний ряд іде поряд і т.д. Розміри листа: ширина 2.5 нм, довжина 2 нм. Більшість складчастих листів мають скручену форму. Скручування йде перпендикулярно до витягнутих ланцюжків.
Поліпептидні ланцюжки можуть перебувати також у невпорядкованій формі.
α-спіралі можуть скручуватись між собою, утворюючи суперспіралі, тобто надвторинні структури. У тропоміозині, легкому мероміозині, параміозині скручені по 2 α-спіралі, в фібриногені – 3 α-спіралі. Суперспіраль стабілізується гідрофобними взаємодіями між окремими спіралями: гідрофобні залишки обох спіралей розташовуються всередині, уникаючи контакту з навколишньою водою.
Інші типи надвторинної структури: комбінації β-складчастих листів, комбінації β-складчастих листів з α-спіралями.
Третинна структура - просторова укладка всього поліпептидного ланцюга. Молекула приймає у просторі термодинамічно найбільш вигідну форму. Нуклеаза стафілококів після денатурації повторно згортається всього лиш за 1 с.
Пояснює процес згортання нуклеацинова модель. Короткі сегменти поліпептидного ланцюга швидко згортаються незалежно один від одного, утворюючи α-спіралі і β-структури, потім зближуються, утворюючи компактну тривимірну структуру. Перехід спіраль – клубок відбувається за 10–6–10–8 с.
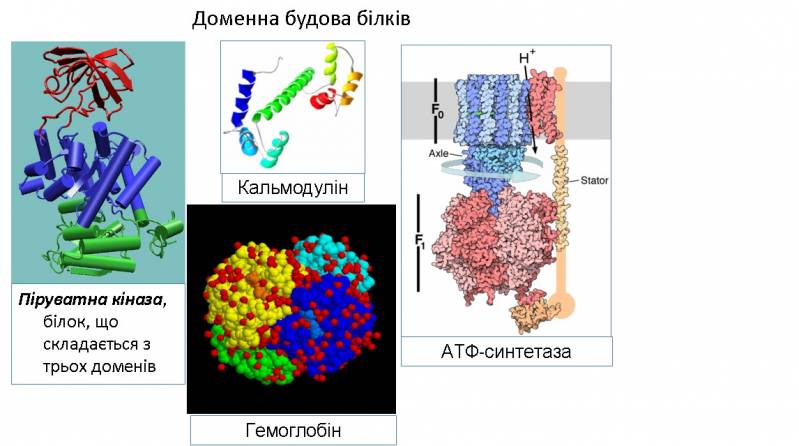
Білки з молекулярною масою >20 000 складаються з кількох глобулярних областей, слабо зв'язаних між собою – доменів (четвертинна структура). Домени згортаються й розгортаються незалежно один від одного. Доменна будова виявлена в імуноглобуліну G, міозину, фібриногені та ін.
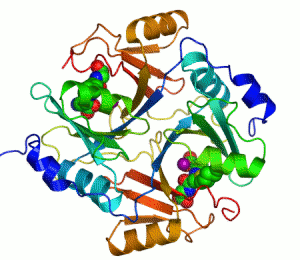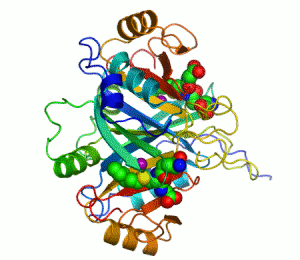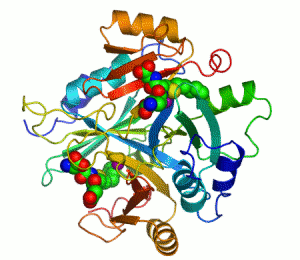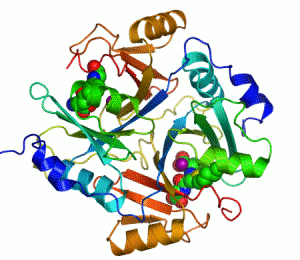
Принцип методу – вимірюється кількість теплоти, необхідна для збільшення температури. Одержується температурна залежність теплоємності, тобто крива плавлення білка. Різні домени мають різні температури плавлення і плавляться незалежно один від одного. За кількістю піків на кривій Cp(T), площею під піками і їхніми висотами можна судити про кількість доменів у білку. Крива плавлення фібриногену (білок згортання крові, M=340 000) має 2 піки: при T=328K і T=368K. Метод ДСМК виявив наявність у фібриногені 12 незалежних структурних доменів. По кілька структурних доменів мають також імуноглобулін G, плазминоген, тропоміозин, міозин тощо.
Перейти вище
