Кооперативність полягає в тому, що зв'язування субстрату одним центром полегшує зв'язування субстрату іншими центрами алостеричного ферменту.
Міоглобін (використовується для запасання кисню у м'язах) має тільки один центр зв’язування кисню. Відповідне рівняння реакції:
X – ліганд,
EX – білок, зв'язаний з лігандом.
Гемоглобін має 4 центри зв’язування кисню. Не обов’язково всі вони одночасно запов-нені. Рівняння реакції кооперативного зв'язування h молекул кисню на гемоглобіні:
Ступінь насичення білка лігандом – відношення концентрації ферменту, зв'язаного з лігандом, до загальної концентрації ферменту.
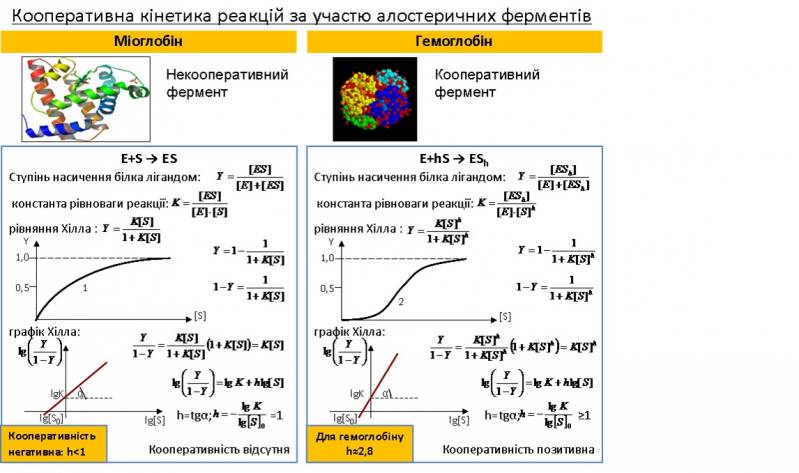
Алостеричні ферменти внаслідок кооперативності мають S-подібну залежність активності від концентрації субстрату.
Одержана лінійна залежність – графік Хілла. По ньому легко визначити константу рівноваги K (перетин прямої з віссю ординат) і коефіцієнт Хілла h, характеризуючий ступінь кооперативності (за кутом нахилу прямої: h=tgα). Для гемоглобіну h=2,8>1, тобто кооперативність позитивна. Якщо h<1, то кооперативність негативна.
Перейти вище