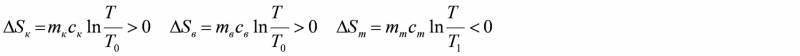Прилади і матеріали: один штатив; три термометри; три калориметри; нагрівач; посудина з водою; три зразки однакової маси, але різної густини (алюміній, залізо, латунь); три зразки різної маси, але однакової густини (латунь); гачок для виймання зразків.
Термодинамічна система – будь-який матеріальний об'єкт, що складається з великої кількості частинок. Область поза системою – навколишнє середовище. Стан системи визначається набором термодинамічних параметрів.
Ізольована система – яка не обмінюється з навколишнім середовищем ні речовиною, ні енергією. Замкнута система – обмінюється з навколишнім середовищем енергією, але обміну речовиною через границі системи не відбувається. Відкрита система – обмінюється з навколишнім середовищем енергією та речовиною (наприклад, живі організми).
Оборотним процесом називається така зміна стану системи, яка будучи проведена у зворотному напрямку, повертає її в початковий стан, так щоб система пройшла через ті самі проміжні стани, що і в прямому процесі, але у зворотній послідовності, а стан тіл поза системою залишився незмінним.
Стан термодинамічної рівноваги системи – якщо термодинамічні параметри не змінюються з часом, однакові по всьому об'ємі системи та відсутній обмін енергією і речовиною з навколишнім середовищем.
Внутрішня енергія U – сума кінетичних і потенціальних енергій молекул термодинамічної системи. Вона залежить тільки від взаємного розміщення та швидкостей молекул системи. Зміна внутрішньої енергії не залежить від того, яким шляхом змінювалась система, а тільки від початкового й кінцевого стану системи. Такі функції, які однозначно залежать тільки від параметрів системи, називаються функціями стану.
Якщо замкнута система оборотно переходить із стану 1 у стан 2, то кількість теплоти Q, яку вона одержує з навколишнього середовища, залежить від шляху. Але, виявляється, що при цьому величина 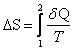 не залежить від шляху переходу з одного стану в інший, а тільки від початкового й кінцевого станів, тобто є функцією стану. Величина S називається ентропією. Одиниця вимірювання ентропії [S]=Дж/К. Елементарна кількість теплоти, яку одержує система в оборотному процесі: δQ=TdS.
не залежить від шляху переходу з одного стану в інший, а тільки від початкового й кінцевого станів, тобто є функцією стану. Величина S називається ентропією. Одиниця вимірювання ентропії [S]=Дж/К. Елементарна кількість теплоти, яку одержує система в оборотному процесі: δQ=TdS.
При передачі теплоти Q системі її ентропія зростає на величину ΔS, а ентропія навколишнього середовища – зменшується, якщо ж система віддає теплоту – її ентропія зменшується. При оборотних процесах теплопередачі всередині ізольованої системи її загальна ентропія не міняється.
При необоротних процесах загальна ентропія ізольованої системи завжди зростає, тобто знак зміни ентропії однозначно визначає напрям необоротного процесу. Ентропія системи змінюється не тільки за рахунок обміну теплотою з навколишнім середовищем, але й за рахунок незворотних процесів всередині самої системи. Тому елементарна кількість теплоти, яку одержує система від навколишнього середовища: δQ‹TdS.
Загальна ентропія зростає, поки система не досягне термодинамічної рівноваги. Отже, нерівноважна система завжди прагне до максимуму ентропії.
Поняття ентропії насправді значно ширше, оскільки ентропія системи може мінятись і без передачі теплоти. Якщо ізольована система перебуває у нерівноважному стані, то перехід у стан термодинамічної рівноваги – необоротний процес, і супроводжується зростанням ентропії. Рівноважний стан – найбільш невпорядкований, хаотичний з усіх можливих станів системи. Тому ентропія – міра безладдя або хаосу.
Формулювання II закону термодинаміки: В ізольованій системі ентропія зберігає постійне значення для оборотних процесів, зростає при необоротних процесах і досягає максимуму у стані термодинамічної рівноваги.
Інше формулювання: Теплота не може самовільно передаватись від менш нагрітого тіла до більш нагрітого, якщо при цьому не відбувається ніяких змін у них або в навколишньому середовищі.
Якщо в калориметр, що містить деяку кількість води при кімнатній температурі Т0, опустити тіло, нагріте до вищої температури Т1, то відбудеться необоротний процес теплообміну і встановиться деяка спільна температура Т. Наявність зовнішньої посудини калориметра робить систему практично ізольованою. При цьому ентропія тіла зменшиться, але сумарна ентропія води і калориметра зросте ще більше, таким чином загальна ентропія ізольованої системи зросте.
В даній роботі система складається:
1) з калориметричної посудини масою mк, питомою теплоємністю cк та початковою температурою T0;
2) води в калориметрі масою mв, питомою теплоємністю св і температурою Т0;
3) тіла масою mт, питомою теплоємністю ст і температурою Т1.
Після закінчення процесу теплообміну і вирівнювання температур до деякого значення Т ентропія елементів системи зміниться:
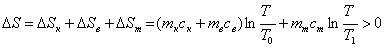
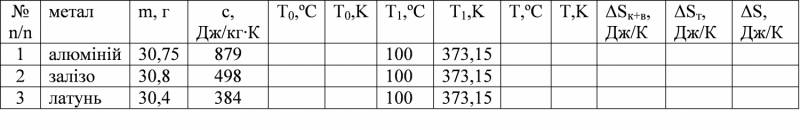
2. Увімкнути нагрівач, на якому знаходиться посудина з водою, попередньо опустивши туди три зразки однакової маси, але різної густини (алюміній, залізо, латунь).
3. Після того, як закипить вода, зачекати не менше трьох хвилин. Потім за допомогою гачка зразки опустіть по одному в калориметри.
4. За показами трьох термометрів слідкуйте за зростанням температур. Зафіксуйте максимальні значення температур Т і запишіть їх в таблицю 1.
5. Налити у три калориметри по 150мл (0,15кг) води.
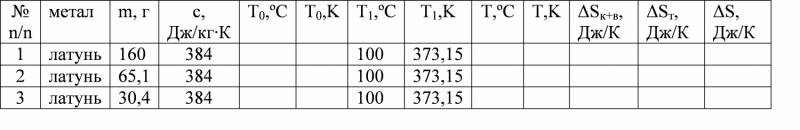
6. Повторити операції, перераховані в пунктах 2-4, для трьох зразків різної маси, але однакової густини (латунь).
7. Значення Т0, Т1, Т занести в таблицю 2.
8. За робочими формулами (1–3) обчислити значення ΔSк+в, ΔSт, ΔS.
9. Записати кінцевий результат для всіх випадків у таблицю та висновок.
2. Чи оборотні процеси нагрівання води; охолодження тіла в воді?
3. Рівноважний і нерівноважний стан.
4. У якому стані перебуває система гаряче тіло – холодна вода; тіло і вода при однакових температурах?
5. Внутрішня енергія.
6. Порівняти внутрішні енергії гарячого і холодного тіла; системи гаряче тіло – холодна вода та тіло і вода при однакових температурах в калориметрі.
7. Ентропія, одиниці вимірювання.
8. Як пов’язана зміна ентропії тіла із кількістю теплоти, яка йому надається чи від нього відбирається при оборотних процесах?
9. Як змінюється ентропія тіла при нагріванні до температури кипіння води?
10. Як змінюється ентропія тіла при охолодженні в калориметрі?
11. Як змінюється ентропія води при зануренні в неї нагрітого тіла?
12. Як змінюється ентропія системи тіло – вода – калориметр при зануренні у воду нагрітого тіла?
13. Яким повинен бути знак зміни ентропії в лабораторній роботі?
14. Формулювання ІІ закону термодинаміки через поняття ентропії.
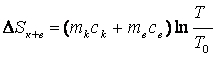 (1)
(1)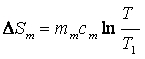 (2)
(2)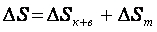 – зміна ентропії системи. (3)
– зміна ентропії системи. (3)Т0 – початкова температура води, [Т0]=К
Т1 – температура кипіння води, [Т1]=К
Т – температури води з різними тілами, [Т]=К
1.2. Табличні величини:
 1.3. Величини, що обчислюються:
1.3. Величини, що обчислюються: ΔSк+в, ΔSт, ΔS – зміна ентропії системи.
II. Результати експерименту
Перша частина роботи:
Таблиця 1. Система (калориметр + вода + тіла приблизно однакової маси з різного матеріалу)
 Друга частина роботи:
Друга частина роботи: Таблиця 2. Система (калориметр + вода + зразки латуні різної маси)
 Результати експериментів підтверджую:_____________________
Результати експериментів підтверджую:_____________________