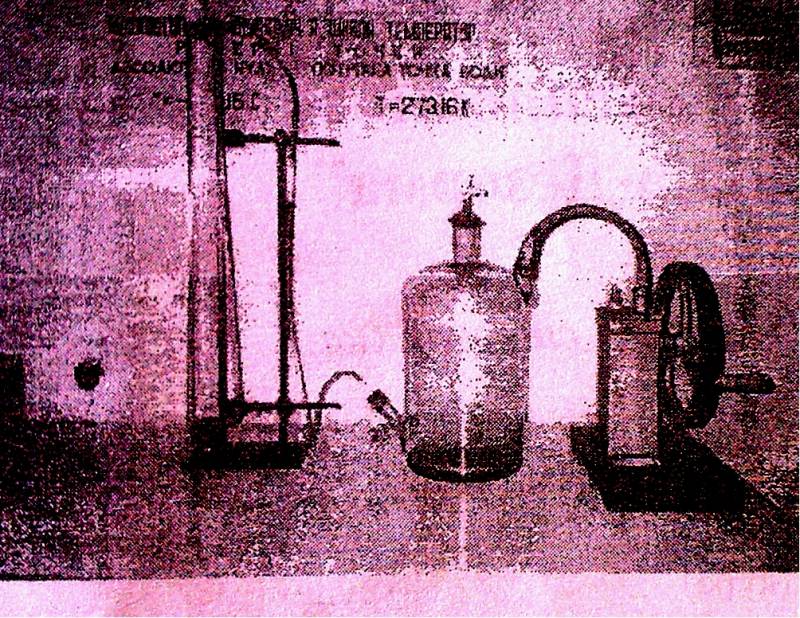
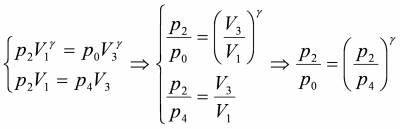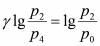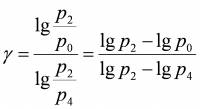Прилади і матеріали: аспіратор, нагнітальний насос, кран, манометр, штатив.
Питомою теплоємністю речовини називаються кількість теплоти, яку необхідно надати одиниці маси речовини для підвищення її температури на один градус.
Молярна теплоємність речовини – величина, яка вимірюється кількістю теплоти, яку слід надати одному молю речовини для нагрівання її на один градус.
Зв’язок між молярною (С) та питомою (с) теплоємностями: С=μс, де μ – молярна маса.
В системі СI одиниці вимірювання теплоємностей такі:
Для питомої: [c]=Дж/(кг•К), для молярної: [C]=Дж/(моль•К).
Для ізопроцесів теплоємності речовин різні. Розрізняють:
Ср – при ізобаричному процесі,
СV – при ізохоричному процесі,
СT – при ізотермічному процесі,
Сад – при адіабатичному процесі.
У фізичних процесах важливими є теплоємності при сталому тиску та сталому об’ємі, причому, Ср > CV, тому що при ізохоричному (V= const) процесі вся теплота dQV=mcVdT, надана газу, йде на збільшення його внутрішньої енергії dU (тобто на нагрівання), а при ізобаричному (p=const) процесі теплота dQp=mcpdT, окрім збільшення внутрішньої енергії, витрачається ще й на розширення газу, тобто здійснюється робота проти зовнішніх сил: dA=pdV=(m/μ)RdT. Таким чином mcpdT=mcVdT+(m/μ)RdT, або (cp-cV)mdT=(m/μ)RdT. Звідси одержуємо рівняння Маєра: μcp-μcV=R, або через молярні теплоємності: Cp-CV=R, Cp=CV+R.
Для реальних газів різниця теплоємкостей може відрізнятися від R. Це зумовлено тим, що внутрішня енергія реальних газів залежить не тільки від температури, а й від об’єму, який він займає.
Числом ступеней вільності (і) називається кількість незалежних рухів, які визначають рух тіла в просторі. По три ступені вільності мають поступальний, обертальний та коливальний рухи. Ждя молекул газу коливальний рух не береться до уваги.
а) молекули одноатомних газів можуть здійснювати три незалежні поступальні рухи вздовж координатних осей, тобто можуть мати три компоненти швидкості, тому і = 3.
б) молекули двоатомних газів окрім трьох поступальних рухів здійснюють ще два обертальні рухи навколо двох перпендикулярних осей, тому і = 5.
в) молекули багатоатомних газів окрім трьох поступальних рухів здійснюють ще три обертальні рухи навколо трьох перпендикулярних осей, тому і = 6.
На кожну складову, тобто на кожний ступінь вільності молекули припадає однакова енергія ½kБT (kБ – стала Больцмана), а в перерахунку на моль вона становить ½RT (адже універсальна газова стала R=kБNA). Отже, внутрішня енергія 1 моля газу U=(i/2)RT, а молярна теплоємність при сталому об’ємі СV=(i/2)R, а при сталому тиску Сp= СV+R=½(i+2)R (на ізобаричне розширення 1 моля будь-якого газу витрачається енергія =R). Якщо надавати 1-атомному газу теплоту, то вона в однаковій мірі розподіляється між трьома ступенями вільності поступального руху. Якщо надавати теплоту 2-атомному газу, то вона в однаковій мірі розподіляється не тільки між трьома ступенями вільності поступального руху але й між 2-ма обертального руху (необхідна більша кількість теплоти). Якщо надавати теплоту багатоатомному газу, то вона в однаковій мірі розподіляється між трьома ступенями вільності поступального руху та між 3-ма - обертального руху. Тому, наприклад, для нагрівання 1 моля багатоатомного газу на 1ºС при незмінному об’ємі необхідно вдвічі більше теплоти, ніж для нагрівання 1 моля одноатомного газу на 1ºС. Якщо ж нагрівання відбувається при сталому тиску, тобто об’єм газу зростає, то для нагрівання 1 моля будю-якого газу на 1ºС необхідна додаткова кількість теплоти для виконання роботи по розширенню газу (величиною R). Отже, для одноатомного ідеального газу молярні теплоємності СV=(3/2)R, Сp=(5/2)R; для двохатомного – СV=(5/2)R, Сp=(7/2)R; для багатоатомного – СV=3R, Сp=4R. Відношення теплоємностей γ=Сp/СV відповідно рівні 1,67, 1,4 та 1,33.
Розглянемо теорію методу Клемана – Дезорма.
Аспіратор об’ємом V0 наповнений повітрям при атмосферному тиску p0 і кімнатній температурі T0.
I стан повітря. При викачуванні насосом повітря, яке було в балоні, займе більший об’єм V1>V0 (розшириться) (будемо вважати, що повітря, яке вийшло з аспіратора, залишилося в системі) та охолодиться (T1‹T0), тиск при цьому зменшиться (p1‹p0). Оскільки процес відбувається дуже швидко, теплообмін між стінками балона і навколишнім повітрям не відбудеться, тобто цей процес – адіабатичний.
II стан повітря. Через певний час після припинення викачування температура повітря в аспіраторі зрівняється з кімнатною (T2=T0), (відбувається ізохоричний процес), тиск відповідно також дещо зросте (p1‹p2‹p0), його величину фіксуємо за допомогою водяного манометра як різницю рівнів h1 в обох колінах.
III стан повітря. На короткий час відкриваємо кран аспіратора, щоб тиск в ньому зрівнявся в атмосферним (рівні рідин у манометрі зрівняються, p3=p0). При цьому повітря ззовні зайде в балон, таким чином стиснувшись до об’єму V0‹V3‹V1. Температура повітря при стисканні зросте до деякого значення T3>T0. Оскільки процес відбувається дуже швидко, теплообмін між стінками балона і навколишнім повітрям не відбудеться, тобто цей процес – адіабатичний. Закриваємо кран.
IV стан повітря. Через деякий час температура повітря в аспіраторі зрівняється з кімнатною: T4=T0‹T3, Оскільки об’єм залишається сталим (V3), процес ізохоричний, то при охолодженні повітря зменшується його тиск: p4‹p3, його величину фіксуємо за допомогою водяного манометра як різницю рівнів h2 в обох колінах.
Перехід зі стану II у стан III є адіабатичним, тому можна записати рівняння Пуассона:
Температури в II та IV станах однакові (рівні кімнатній), тому згідно закону Бойля – Маріотта для переходу II → IV маємо:
Розв’яжемо систему 2-х останніх рівнянь відносно γ:
Прологарифмуємо останню рівність: Звідки:Розкладемо lgp2 i lgp4 в ряд Тейлора та обмежимось двома першими членами:
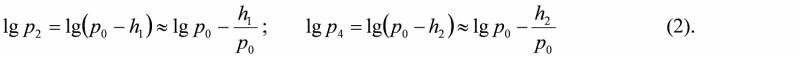
Підставивши вирази (2) у вираз (1) для γ, отримаємо:
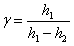 ............................. (3)
............................. (3)2. На короткий час відкрити кран аспіратора, щоб тиск в ньому зрівнявся в атмосферним (рівні рідин у манометрі зрівняються) і закрити кран. Через кілька хвилин зафіксувати різницю рівнів манометрів h2.
3. Відкрити кран аспіратора для встановлення у ньому атмосферного тиску та кімнатної температури, закрити його.
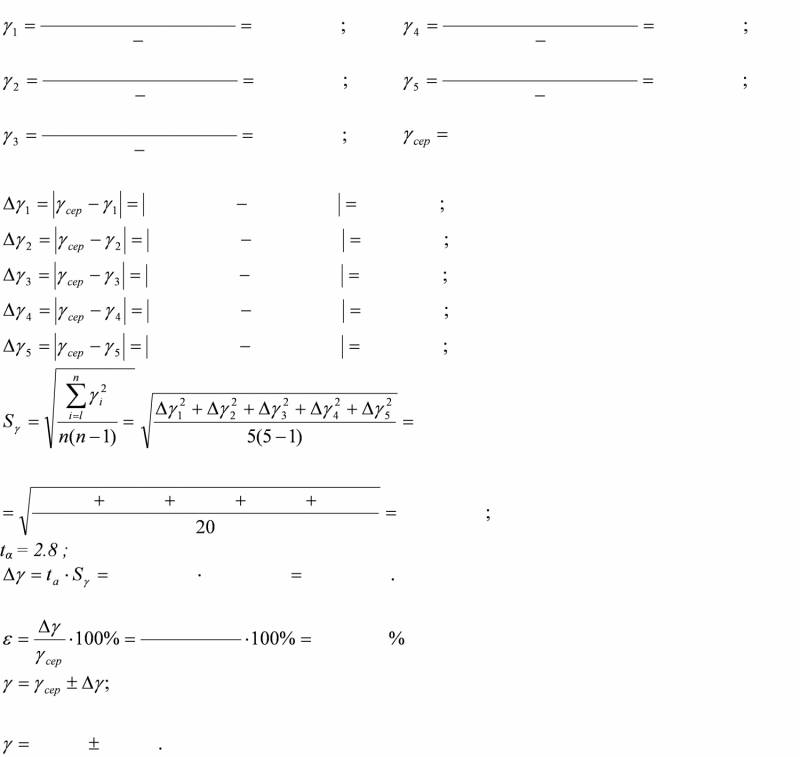
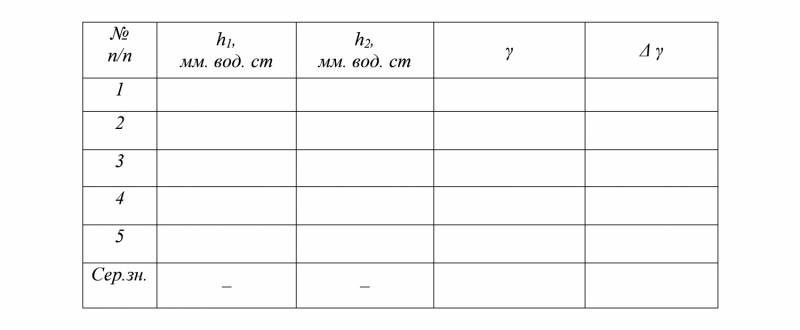
4. Дослід повторити 5 разів. За формулою (3) обчислити відношення теплоємностей γ.
5. Результати експерименту занести в таблицю.
 Результати експериментів підтверджую:_____________________
Результати експериментів підтверджую:_____________________ 2. Рівняння Мендєлєєва – Клапейрона.
3. Який процес відбувається при накачуванні, як змінюються при цьому параметри газу?
4. Який процес відбувається між накачуванням і першим вимірюванням тиску, як змінюються при цьому параметри газу?
5. Який процес відбувається при відкриванні крана, як змінюються при цьому параметри газу?
6. Який процес відбувається між накачуванням і другим вимірюванням тиску, як змінюються при цьому параметри газу?
7. Чи відбувається обмін теплотою із зовнішнім середовищем у кожному з вищеописаних процесів?
8. Гідростатичний тиск стовпчика рідини.
9. Пояснити принцип вимірювання тиску газу водяним манометром.
10. Внутрішня енергія ідеального газу.
11. Адіабатний процес, рівняння адіабати, показник адіабати.
12. Питома теплоємність, одиниці вимірювання.
13. Робота розширення газу.
14. Чому і як теплоємність газу при постійному тиску відрізняється від теплоємності при постійному об’ємі?
15. Ступені вільності, їхня кількість для різних молекул.
16. Показник адіабати для різних молекул. Яке його теоретичне значення в лабораторній роботі?
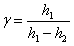 – відношення теплоємностей.
– відношення теплоємностей. 1.1 Величини що вимірюються.
h1 – різниця рівнів рідин після нагрівання повітря до кімнатної температури, [h1]=мм.вод.ст.;
h2 – різниця рівнів рідин після відкриття і швидкого закривання крану аспіратора, [h2]=мм.вод.ст.
1.2 Табличні величини.
1 мм.вод.ст. = 9,81 Па;
1.3 Величини що обчислюються:
γ – відношення теплоємностей.
Обробка результатів експерименту.